BELongDead – Multitrophe funktionelle Diversität im Totholz (BLD-MultiFuncDiv)

Totholz ist eine wichtige Kohlenstoff- und Nährstoffquelle in Waldökosystemen, die kontinuierlich von Makro- und Mikroorganismen abgebaut wird, welche dadurch das Ökosystem strukturieren und zahlreiche Ökosystemfunktionen beeinflussen. Obwohl in den letzten Jahren viele Beiträge zur Artenvielfalt einzelner taxonomischer Gruppen in Bezug auf verschiedene Totholzsubstrate geleistet wurden, fehlt uns noch immer ein umfassendes Verständnis darüber, wie sich die holzbewohnenden Arten im Laufe der Zeit organisieren und zusammensetzen und wie sie spezifisch zu den Holzzersetzungsprozessen beitragen.
Innerhalb der Biodiversitäts-Exploratorien bieten zwei Feldexperimente eine einzigartige Gelegenheit, wichtige Wissenslücken im Bezug auf den durch die holzbewohnenden Arten vermittelten Zersetzungsprozess, zu schließen:
(I) Das BELongDead (Biodiversity Exploratories Long-term Deadwood) Experiment untersucht den Zersetzungsprozess von 13 Laub- und Nadelbaumarten der gemäßigten Zonen und die Umweltfaktoren, welche diesen Ökosystemprozess beeinflussen. Dies ermöglicht uns ein besseres Verständnis der Mechanismen, welche die Artenvielfalt und den Aufbau von Gemeinschaften während der teils vollständigen Holzzersetzung in Abhängigkeit von der Intensität der Waldbewirtschaftung und der Waldstruktur bestimmen.
Dabei untersuchen wir:
- a) wie Arten ein Totholzobjekt besiedeln,
- b) wie Gemeinschaften aus verschiedenen Taxa während der Sukzession interagieren,
- c) wie sich der Einfluss der Holzeigenschaften und der der Umwelt auf die Kolonisierungsgemeinschaften über die Sukzession verändert und
- d) ob sich kausale Zusammenhänge zwischen Diversität und Abbau besser verstehen lassen, wenn mehrere Taxa berücksichtigt werden.
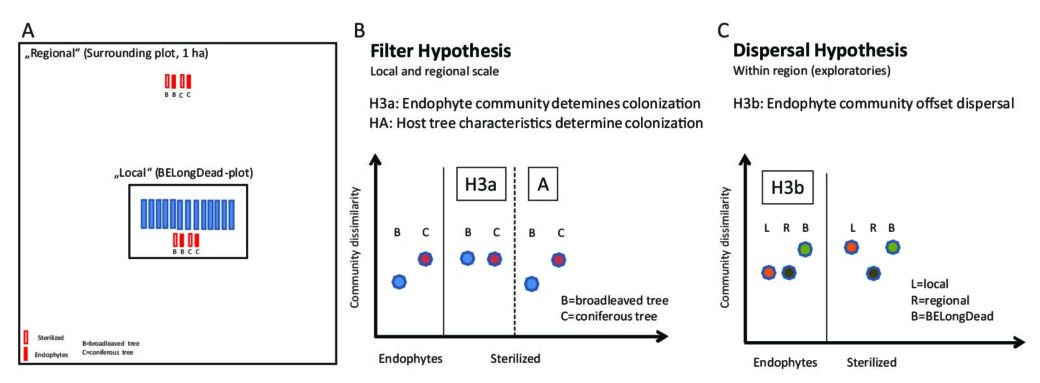
(II) Mit dem BESterile-Experiment (Biodiversity Exploratories deadwood sterilization experiment) konzentrieren wir uns auf die Mechanismen der Artenbesiedlung und die damit zusammenhängenden Prozesse unter verschiedenen Waldbewirtschaftungsintensitäten in der frühen Sukzessionsphase. Zu diesem Zweck wurden die Stämme von zwei Hauptbaumarten mitteleuropäischer Wälder (Fagus sylvatica und Picea abies) teils gammasterilisiert oder nicht sterilisiert (Holz mit natürlichen Endophyten) und dann neben den vorhandenen BELongDead-Stämmen oder in einem genau definierten Abstand platziert (siehe Abb. 1A).
Dabei untersuchen wir:
- a) Zeigt ein Vergleich zwischen den nicht sterilisierten Stämmen (gekennzeichnet durch die Endophytengemeinschaft) und den sterilisierten Kontrollen einen Unterschied in der kolonisierenden Diversität und schlussfolgernd in der Holzabbaurate? Werden die Unterschiede zwischen verschiedenen Baumarten hauptsächlich durch die Endophytengemeinschaften (Abb. 1B, Hypothese H3a) oder alternativ durch die Eigenschaften des Wirtsbaums (z.B. physikalisch-chemische Eigenschaften des Holzes, Abb. 1B, Hypothese H3A) verursacht?
- b) Wir erwarten, dass die Kolonisierung vom Spenderpool abhängt und somit Unterschiede in den Besiedlungsmustern zwischen den Stämmen direkt an BELongDead (stärker am lokalen Artenpool) und jenen in weiter Entfernung auftreten (stärker am regionalen Artenpool). Wenn die endophytische Gemeinschaft die Kolonisierung bestimmt, werden wir eine ähnlichere Artengemeinschaft zwischen allen Stämmen beobachten (Abb. 1C, Hypothese H3b).
I) BELongDead
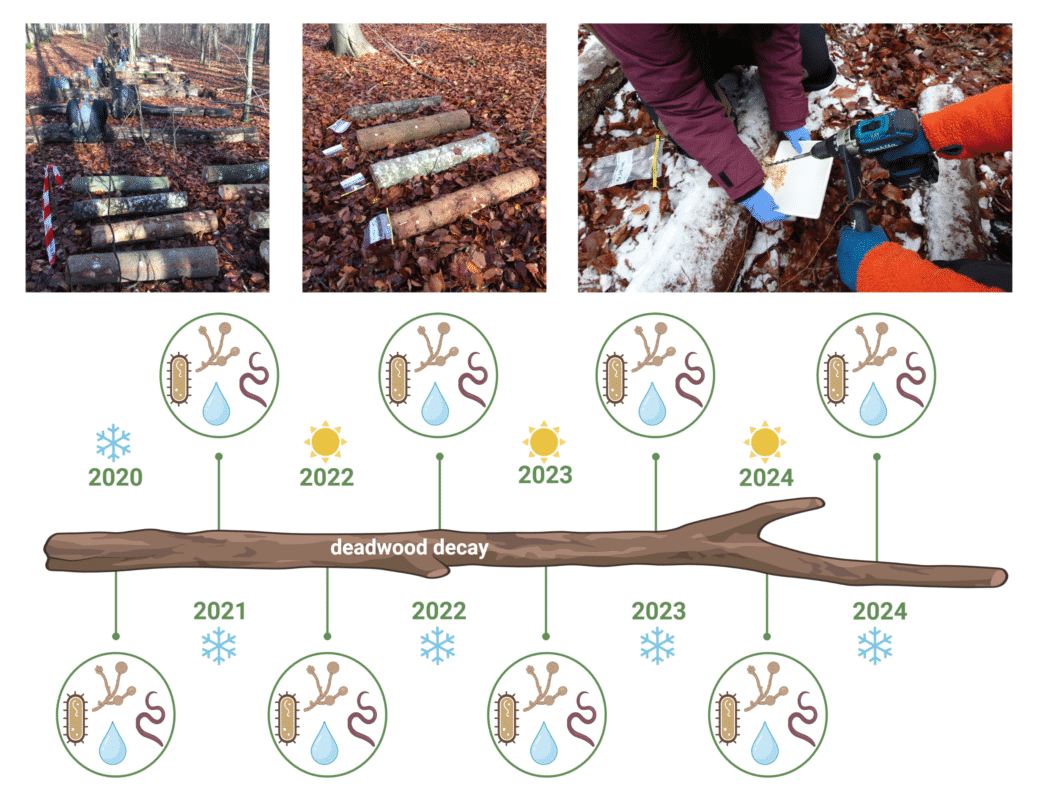
Nach Holzprobenahmen in den Jahren 2012, 2015, 2017 und 2020 wird unser Datensatz um einen fünften Zeitpunkt im Jahr 2023 erweitert, um die Prozesse der Holzzersetzung von der ersten bis zur weit fortgeschrittenen Zersetzungsphase zu bewerten (Abb. 2). Für jeden Zeitpunkt haben wir die totholzbewohnende Pilz- und Bakteriengemeinschaft mittels Amplikonsequenzierung nach standardisierten Protokollen untersucht. Diese Daten werden durch verschiedene Holzmerkmale, abbauende Enzymaktivitäten und die Vielfalt von Pilzfruchtkörpern, Archaeen und Nematoden für mehrere Probenahmekampagnen ergänzt (Abb. 3).
II) BESterile
Seit Herbst 2020 (Zeitpunkt T0) werden zweimal im Jahr Holzproben nach dem standardisierten BELongDead-Protokoll entnommen. Diese Proben werden zur Untersuchung der Bakterien-, Pilz- und Nematodenvielfalt mittels Amplikonsequenzierung und grundlegender Holzmerkmale wie pH-Wert und Wassergehalt verwendet (Abb. 4).